什么是免疫组化?
免疫组织化学(简称免疫组化,Immunohistochemistry,IHC)是组织化学的一种,它是利用抗原与抗体特异性结合的原理,通过化学反应使标记于结合后的特异性抗体上的显示剂(如酶、金属离子、同位素等)显示一定的颜色,并借助显微镜观察其颜色的变化,从而对组织切片或细胞标本中的某些化学成分进行原位的定性、定位或定量研究。
简单来说,免疫组化就是一项利用抗原抗体反应来确定组织细胞内抗原和对蛋白定位、定性的实验技术。
由于免疫组化具有特异性强、灵敏度高、定位准确等特点,且能将形态研究与功能研究有机结合在一起,所以这门新技术已被广泛应用于生物学和医学研究的许多领域。
基本原理
抗原与抗体之间的结合具有高度的特异性。免疫组化正是利用这一特性,先将组织或细胞中的某些化学物质提取出来,以其作为抗原或半抗原去免疫小鼠等实验动物,制备特异性抗体,再用这种抗体(第一抗体)作为抗原去免疫动物制备第二抗体,并用某种酶或生物素等处理后,再与前述抗原成分结合,将抗原放大。
由于抗体与抗原结合后形成的免疫复合物是无色的,因此还必须借助于免疫组织化学将抗原抗体反应部位显示出来。常用显色剂DAB显示为棕黄颗粒。
实验操作流程
实验过程包括切片制作,脱蜡,水化,抗原修复,非特定位点封闭,一抗孵育,二抗孵育,DAB显色,复染,封片,分析。
脱蜡水化
因切片上的石蜡会妨碍染色,所以需将切片上的石蜡溶出,并水化。
脱蜡前,先将石蜡切片放置于烤片机或60°烘箱烤片30-60min,这一步是为了使蜡片水分蒸发和石蜡融化,好让组织切片牢固地贴在玻片上。烤完片子后,将其放入二甲苯(Ⅰ)中浸泡10min,更换二甲苯(Ⅱ)再浸泡10min,进行脱蜡。
PS:
脱蜡不全,组织出现非特异性背景着色现象。原则上是要彻底、干净、完全地脱去切片上的蜡。
为了脱蜡脱干净,可把切片放置在切片架上竖放进行烤片。
因为石蜡是不溶于水的,如果石蜡脱不完全,水流上去会模糊还有滞流感。
水化
在无水乙醇(Ⅰ)浸泡10min,更换无水乙醇(Ⅱ)再浸泡10min,然后依次95%乙醇,70%乙醇,50%的乙醇各5min,最后用蒸馏水浸泡5min。PBS洗3次,3min/次。
PS:
保持玻片在自来水中,直到准备进行抗原修复。任何时候都不应该使玻片干燥,干燥会导致非特异性抗体结合,从而出现高背景染色。
抗原修复
抗原修复是免疫组化中不可忽略的关键步骤。原因是组织经福尔马林等固定液固定和石蜡包埋后,抗原决定簇与核酸易发生交联,引起蛋白质空间结构的改变,导致抗原决定簇被封闭,是抗原与抗体结合点减少,从而令抗原抗原的阳性检测率及着色强度相对减弱。这种交联在高温加热或是蛋白酶水解作用下会发生可逆反应,恢复蛋白的原有构象,这一过程就是抗原修复。
通过抗原修复,使得细胞内抗原决定族重新暴露,提高抗原检测率。
修复方法从强到弱一般分为三种,高压修复、微波修复、胰酶修复。(可根据条件选择合适的修复方法进行修复)
■ 高压修复:把抗原修复液倒进高压锅中先加热煮沸,然后放入切片进行高压,高压结束,把高压锅放置在水流下降温放气。打开盖子自然冷却至少半小时。注意整个修复过程要保证修复液足够,修复过程切片始终浸没在修复液中。
■ 微波修复:将切片置入盛有抗原修复液的容器中,将容器置入微波炉内高档加热至修复液沸腾,将微波炉调至低档维持加热10分钟,将容器连同修复液和切片移出降至室温。
■ 煮沸修复:先把抗原修复液倒入锅中,先进行煮沸,然后放入切片,关盖不关严,注意修复时间,防止爆沸造成脱片,修复完成打开盖子,室温冷却至少半小时。
抗原修复缓冲液也分为多种,常用的则为柠檬酸盐缓冲液(pH6.0),EDTA缓冲液(pH8.0-9.0),Tris/Tris-EDTA缓冲液(pH9.0-10.0),或者胰酶法(pH3.5±0.2)。
同组织,不同PH值抗原修复液其染色结果强度不一样。有些抗原随抗原修复液PH值的变化,其染色强度没有明显变化;有些抗原随抗原修复液PH值的升高,其染色强度降低后又升高,有些抗原随抗原修复液PH值升高,其染色强度升高。
没有一种抗原修复缓冲液可以适用于所有抗原。大部分抗原在修复液pH 8.0-9.0的范围值可以获得一个普遍较好的修复效果,所以碱性缓冲液应用普遍些。
消除内源性过氧化物酶的活性
用3%H2O2滴加到切片上,封闭5-10min去除内源性过氧化物酶。PBS冲洗2-5min,冲洗三次。
PS:
在一些过氧化物丰富的组织里面(肝脏、胎盘、血管瘤、急性炎症组织等)3%H2O2也不能完全消除内源性的过氧化物,改进的方法就是先用3%H2O2阻断10min,再用0.5%的高碘酸溶液阻断10min。
非特定位点封闭
为了防止一抗的非特异性结合造成假阳性,可以选用BSA、羊血清等封闭非特异性结合位点。
PS:
根据二抗系统中是否含有生物素而选择封闭剂,无生物素的二抗系统可以不使用封闭剂。封闭时间过长,会导致阳性信号减弱甚至出现假阴性;封闭时间不足,会导致背景增强甚至出现假阳性。
封闭试剂原则上是选择二抗动物的非免疫血清封闭一些非特异性结合位点,例如二抗是羊抗兔,就要选择非免疫羊血清。
一抗孵育
免疫组化耗时长,步骤繁多,为了得到特异性染色,获得可靠结论,选择合适的一抗十分关键。基本原则是选择选择特异性强,灵敏度高,背景低的抗体,结果稳定、重复再现性良好的抗体。
抗体的特异性体现在组织特异性,细胞特异性,细胞亚定位的特异性。
在抗原抗体反应中,一般单克隆抗体特异性强,但亲和力相对小,检测抗原灵敏度相对就低;而多克隆抗体特异性稍弱,但抗体的亲和力强,灵敏度高,但易出现非特异性染色。
PS:
一抗的冲洗原则:单独冲洗,防交叉反应污染;温柔冲洗,防止切片脱落;推荐浸洗方式。
二抗孵育
使用不同显色系统,可以呈现不一样的显色效果。
切片显色
加入配置的DAB显色液进行染色。
DAB显色时间不是固定的,主要由显微镜下控制显色时间,到出现浅棕色本底时即可冲洗。
DAB 显色时间很短(如几秒或几十秒)就出现很深的棕褐色,这很可能说明你的抗体浓度过高或抗体孵育时间过长,需要下调抗体浓度或缩短抗体孵育时间。
若很短时间就出现背景很深,还有可能是你前面的封闭非特异性蛋白不全,需要延长封闭时间。
DAB 显色时间很长(如超过十几分钟)才出现阳性染色,一方面可能说明你的抗体浓度过低或孵育时间过短(最好一抗 4ºC 过夜);另一方面就是封闭时间过长。
复染:
为了形成细胞轮廓,更好的定位目标蛋白,可用苏木素苏木精,细胞核蛋白几秒就可以,细胞浆或者细胞膜蛋白需要然20-30S,自来水冲洗,再用PBS返蓝5min。
Ps:
复染的时间是需要摸索的,这个与苏木精的配制时间有关。
如果染色过浅可重复染色,如果染色过深可使用盐酸进行分化。
若试验目的只是想说明组织中蛋白表达的有无、量的多少和颜色的深浅,那就不需要苏木素复染;若实验目的是想看组织切片蛋白定位在胞核还是胞浆,那就最好苏木素复染。
脱水
依次用50%, 70%, 95%酒精各5min浸泡切片,最后用100%酒精浸泡10min,更换酒精浸泡10min,最后用二甲苯浸泡10分钟,更换二甲苯,再浸泡10min。
PS:
梯度酒精的作用:脱水,以便片子长期保存;二甲苯是为了使片子更加透明。
封片
捞出,加入中性树胶封片。滴加一滴树胶在组织旁盖上玻片,注意小心不要有气泡,树胶适量,如果树胶滴多了可使用二甲苯小心擦拭多余的树胶。
PS:
有条件的话最好立即拍照,若不能及时拍照,也要封好片和用指甲油封固,保持避光和湿度。
结果分析
镜下细胞核呈蓝色,阳性结果呈深浅不一的棕色。免疫组化标记时细胞阳性着色程度取决于抗原含量、分布密度和标记方法及其敏感性。一般而言,抗原含量越多,分布密度越高,标记方法越敏感,阳性结果显色则越强。根据阳性标记的显色程度分为:淡黄色,提示为弱阳性;棕黄色,为中等度阳性;棕黑色,示为强阳性。
结果分析主要有两种方法:
■ 阳性着色细胞计数法:在40倍光镜下,选择不重叠的10个视野,人工或机器计数阳性着色细胞。
■ 评分法:在光学显微镜下按染色程度(0分阴性着色,1分淡黄色,2分浅褐色,3分深褐色)和阳性范围(1分0-25%,2分26-50%,3分51-75%,4分76-100%)评分,最终分数相加。
随着数字病理时代快速发展,自动图像分析方法提供了快速、统一的IHC染色指标判读方法,将主观变得更为客观,结果更加可靠。图像分析软件推荐:Image J。
免疫组化结果的判断原则
(1)必须设染色对照
没有对照染色的免疫组化结果是不可信的,免疫组化染色结果判定必须建立在对照染色实验成立的基础上。
对照一般有阳性组织对照,阴性组织对照,阴性试剂对照,自身对照。一般来说,有一个阳性组织对照和一个阴性组织对照就足够了。
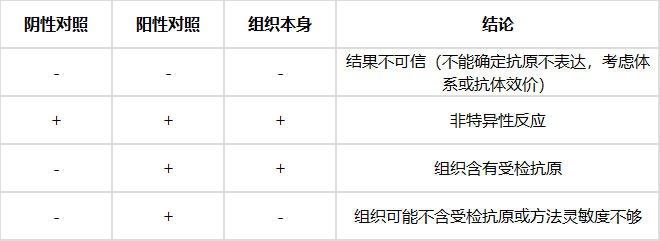
(2)染色阳性定位准确
染色阳性结果应表达在预期对应的组织结构中抗原特定部位上,且定位清晰准确,明确抗体标记的确切位置是核、质、膜还是血管壁或间质成分或复合表达,且无背景染色(或背景和阳性显色可明显区分)。
不在抗原所在部位的阳性着色,一概不能视为阳性。
(3)观察位置选择合适:尽量避开出血、坏死及切片刀痕和界面边缘细胞的阳性表达。此类阳性着色多存在内源或人为因素干扰。
(4)免疫组化与HE切片诊断应以HE切片诊断为准
当免疫组化诊断结果与HE切片诊断不一致时,应再结合临床资料、X线等影像学及实验室结果综合分析,不能用免疫组化检查结果推翻HE切片诊断。
常见问题
免疫组化是一项复杂的实验,需要考虑和优化多个参数,实验中常常会遇到各种问题,导致实验结果不理想。
这里,小编汇总了一些实验中常见的问题,希望能给大家带来帮助
(1)非特异性染色:一张片子染得脏脏的
■ 一抗用多克隆抗体容易出现非特异性染色,建议用高纯度,高效价的针对更具特异性抗原决定簇的单克隆抗体来解决。
■ 一抗浓度太高也是出现非特异性染色的常见原因。解决的办法就是预实验。
■ 另一个常见原因就是孵育时间过长。解决的办法就是定时器。加上抗体后,立刻调好定时器,提醒自己及时终止反应,就会避免这个问题。
■ DAB的孵育时间过长,会造成背景非特异性染色。DAB的显色时间不是一成不变的,主要靠自己在显微镜下盯着,一旦出现浅浅的棕色的时候,就要马上冲洗。出现棕色的时间过短,表明抗体浓度过高;出现棕色的时间过长,表明抗体浓度过低。
因为DAB显色液配置好了之后极容易产生DAB的沉积,DAB要现用现配,临用前才加入H2O2。
■ 内源性酶和生物素也会造成非特异性染色,特别是一些内源性酶生物素含量丰富的组织,如肝脏,肾脏,脾脏等,需要通过延长封闭时间和增加封闭剂浓度来降低背景染色。
■ 防止标本染色过程中出现干片,这容易增强非特异性着色。建议:一次少染几张。
■ 适当增加PBS冲洗次数和浸洗时间,在一抗、二抗或SP孵育之后的浸洗尤为重要;
■ 石蜡切片脱蜡不彻底,建议:延长脱蜡时间
(2)细胞核模糊,对比不鲜明。
通常组织离体2h后抗原完全丢失。建议:组织离体后尽快固定
(3)切片太厚,有刀痕,有褶皱
建议:切片厚度视组织而定,如同淋巴结、肾等需要比较薄(不超过3um),脑组织需要较厚(尤其是取新鲜标本冰冻制片时),常规都要6-8um最佳,冰冻可切至10um;其他一般如胃肠道、肝胆等等组织,2-4um均可,太厚易掉片,细胞重叠,影响观察。
切片角度和刀片新旧程度对切片效果的影响较大,新刀片容易切出完好的切片。
(4)染色液的堆积,建议:充分洗涤。














